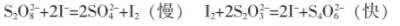【例1】(2012·广东理综,32)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O?葑2Ca2++2K++Mg2++4SO42-+2H2O
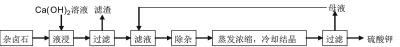
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca (OH)2溶液能溶解杂卤石浸出K+的原因 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
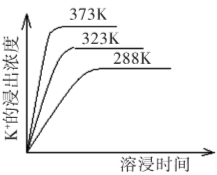
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图,由图可得,随着温度升高,① ,② 。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(S)+CO32-?葑CaCO3(S)+ SO42-。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K (计算结果保留三位有效数字)。
【题型分析】这是一道典型的无机化工流程图题,其特点是以元素及其化合物的知识为载体,以无机化工生产为主要背景,以化工流程图为主要信息形式,综合考查基本概念和理论、化学实验、化学计算等相关知识。本题还涉及反应机理、坐标图像等信息,体现了对学生综合处理信息能力的要求。
【解题思路】在解答本题的过程中,若只是简单地利用已给信息,有些问题的解决会碰到困难,故必须挖掘试题中蕴含的条件。如:
问题(1):需要挖掘两个蕴含条件。一是,用饱和Ca(OH)2溶液溶浸杂卤石过程中,OH-减少的量与Ca2+增加的量相等,但Ca(OH)2沉淀平衡受OH-的影响大于Ca2+,所以随着反应的进行,[Ca2+]·[ OH-]2<Ksp[Ca(OH)2],不会产生Ca(OH)2沉淀;二是,CaSO4是微溶物质,随着反应的进行,必然会产生CaSO4沉淀。
问题(3):“除杂”除了要把杂质除去,更隐含着不能引进新杂质,所以要除去的是Ca2+,最后得到的是纯净K2SO4,所加试剂及顺序自然明了。
问题(5):直接进行平衡常数运算无法入手。但所给条件分别隐含着Ksp(CaCO3)= [Ca2+]·[ CO32-]=2.80×10-9,Ksp(CaSO4)=[Ca2+]·[ SO42-]=4.90×10-5,所以很容易计算到K=[ SO42-]/[ CO32-]= Ksp(CaSO4)/Ksp(CaCO3)= 4.90×10-5/2.80×10-9=1.75×104。
【参考答案】(1)Mg(OH)2,CaSO4。(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(3)K2CO3,稀H2SO4。(4)①在同一时间K+的浸出浓度大;②反应的速率加快,平衡时溶浸时间短。(5)1.75×104。
三、发掘潜在规律
有些试题会给出一系列的信息链,以一组一组的信息形式出现,使信息容量变得特别大。在这类信息阅读时,不容易理清思路,解题也就没有了头绪。其实,这类信息链之间蕴含着潜在的规律,只要找到信息链内的潜在规律,就能找到问题解答的思路。
【例3】(2012·广东理综,31)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:|
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S2O3-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
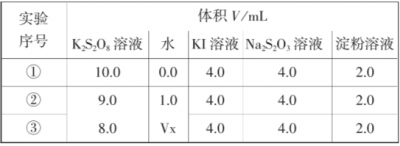
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx= mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图3所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI(s);△H
已知:4Li(s)+O2(g)=2Li2O(s); △H1