⑤判断电极反应是否正确:一看得失电子有没有弄错,二看反应条件是酸性还是碱性,酸性时不能出现氢氧根离子,碱性时不能出现氢离子,也不能生成二氧化碳而是生成碳酸根。
⑥电镀时镀件作阴极,镀层金属做阳极,电镀液含镀层金属离子的溶液;精炼铜时精铜作阴极,粗铜做阳极,比铜金属性活泼强的杂质失去电子进入溶液中,比铜金属性活泼性弱的杂质在阳极附近形成阳极泥。
⑦电解质溶液中的阳离子的移动方向与外电路的电流方向相同,即向正极(阴极)移动;阴离子的移动方向与外电路的电子移动方向相同,即向负极(阳极)移动。
⑧金属腐蚀分化学腐蚀(直接反应化学反应、没有形成原电池)和电化学腐蚀(形成原电池),钢铁腐蚀是电化学腐蚀,负极失去电子形成二价铁离子,碱性条件氧气得电子(吸氧腐蚀),酸性条件氢离子得电子(析氢腐蚀)
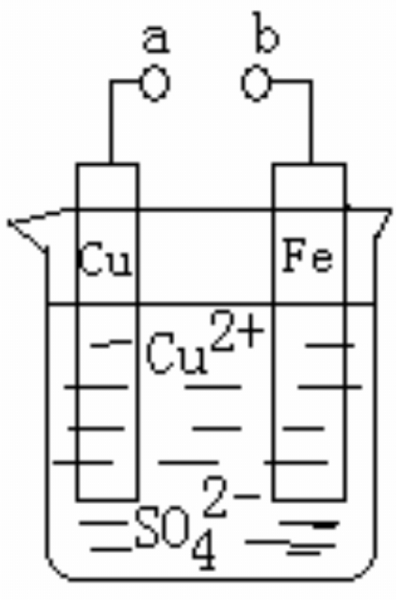
【典例4】(2011年广东理综)某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
解析:a和b不连接时没有构成原电池,铁片直接与Cu2+发生置换反应,生成的铜附着在铁片上,A选项正确。a和b连接时构成原电池,铁片做负极失去电子,铜片做正极,溶液中铜离子在铜片上得到电子析出单质铜,B选项正确。无论a和b是否连接,总反应都是铁置换出Cu2+,C选项正确。a和b分别连接直流电源正、负极时,铜为阳极,铁为阴极,Cu2+应向阴极方向移动。
答案:D
考点五 无机物的性质与用途
复习策略:无机物性质与用途的试题涉及知识面较广,容易出现由于知识存在漏洞而失分的问题。复习中,一要注意从氢化物、单质、氧化物、对应的酸、盐的关系归纳硅、氯、硫、氮等非金属元素的性质,从单质、氧化物、对应的碱、盐的关系归纳钠、铝、铁、铜等金属元素的性质。二要注意物质结构、性质和用途之间的关系。三要注意物质的一些特殊性质,以及有关社会、生活中的热点问题。
重点知识与注意问题
①Na2O2可作呼吸面具和潜水艇中的供氧剂;NaHCO3、Al(OH)3可用于治疗胃酸过多;NaHCO3用于制造发酵粉;Na2CO3用于制玻璃、造纸和食用碱。
②铝热剂(铝与金属的氧化物的混合物)可用于焊接钢轨、冶炼难熔金属,FeCl3溶液可与单质铜反应,用作腐蚀印刷电路板。
③Cl2、HClO、Na2O2、H2O2由于强氧化性使有色物质(品红、石蕊)褪色;SO2使品红褪色但不能使石蕊褪色,SO2可用于工艺品的漂白,但不能用于食品漂白;活性炭具有吸附作用(物理变化),也能使有色物质褪色。
④晶体硅可用作半导体材料、太阳能电池和硅合金。SiO2用作制造光导纤维、光学仪器,石英还可用于制玻璃。玻璃、水泥、陶瓷都是含硅酸盐的混合物。
⑤Cl2、ClO2、NaClO、漂白粉和高铁酸钾等可用于自来水的消毒杀菌,明矾(硫酸铝钾)可用作净水剂。
⑥酸雨是由于空气中含硫、氮的氧化物形成的,碳的氧化物不会形成酸雨,CO2只是形成温室效应。
⑦钠和氧气的反应产物与反应条件有关(金属钠在常温条件下与氧气反应生成Na2O,在加热条件下与氧气反应生成Na2O2);铜和硝酸反应产物与硝酸的浓度有关(浓硝酸生成NO2,稀硝酸生成NO);铝盐溶液与氢氧化钠溶液反应产物与氢氧化钠的量有关(氢氧化钠不足生成氢氧化铝、氢氧化钠过量生成偏铝酸钠)。
⑧钝化是在冷的浓硫酸、浓硝酸中铝、铁等金属的表面形成一层致密的氧化膜而阻止了反应,但不是没有发生化学变化。
⑨过氧化钠为淡黄色,氧化铁为红色,四氧化三铁为黑色,氢氧化亚铁为白色,氢氧化铁为红褐色;氢氧化铜和五水硫酸铜均为蓝色、无水硫酸铜为白色,氧化亚铜为红色。单质硫为淡黄色,氯气为黄绿色。
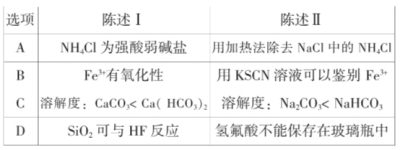
【典例5】(2013年广东理综)下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
解析:加热法除去NaCl中的NH4Cl,是利用NH4Cl受热易分解的性质,与强酸弱碱盐没有关系,A选项不符合题意。用KSCN溶液可以鉴别Fe3+,是利用Fe3+与SCN-生成配合物呈红色,与Fe3+的氧化性无关,B选项不符合题意。相同温度下Na2CO3的溶解度大于NaHCO3,C选项错误。氢氟酸不能保存在玻璃瓶中,是由于HF能与玻璃中的SiO2反应。
答案:D