复习策略:元素周期表和元素周期律的试题,主要考查对短周期元素在元素周期表中的位置及其性质递变规律的综合运用能力。在复习中,要注意掌握好元素周期表的结构(熟记前3周期的元素)、同主族、同周期性质变化规律、以及离子键和共价键的知识,并努力提高运用图、表中的信息进行推理的能力。
重点知识与注意问题
①)同周期元素,从左到右,元素的原子半径逐渐减小(稀有气体元素除外);元素的金属性逐渐减弱、非金属性逐渐增强;元素的最高正价由+1递增到+7(O、F除外),而负价由-4递增到-1;元素的最高价氧化物对应水化物的酸性逐渐增强、碱性逐渐减弱;元素的气态氢化物的稳定性逐渐增强。
②)同主族元素的最高正价相同(O、F除外),元素的最低负价也相同。同主族元素,从上到下,元素的原子半径逐渐增大;元素的金属性逐渐增强、非金属性逐渐减弱;元素原子的氧化性逐渐减弱,还原性逐渐增强;元素的最高价氧化物对应水化物的酸性逐渐减弱、碱性逐渐增强;元素的气态氢化物的稳定性逐渐减弱。
③元素周期表中最外层电子数相同的元素不一定位于同一个族,如He和Mg;同族元素最外层电子数不一定相同,如He与Ne,但同主族元素的最外层电子数一定相同。
④元素种类最多的族是ⅢB族(含镧系、锕系);形成化合物最多的元素是碳元素(有机物的种类繁多)。
⑤同主族元素的原子半径(或离子半径)都是随着原子序数的增加而逐渐增大;电子层结构相同的离子,原子序数越大,微粒半径越小;同周期元素形成的离子,阴离子半径一定大于阳离子半径。
⑥碱金属单质的熔点、沸点随原子序数的增大而降低,卤素单质的熔点、沸点随原子序数的增大而升高。
⑦共价化合物中只能含有共价键,而离子化合物中除一定有离子键外,还可能有共价键(如氢氧化钠含极性共价键,过氧化钠含非极性共价键)。
⑧不是任何物质中都含有化学键,如稀有气体;金属元素与非金属元素可形成共价化合物,如AlCl3;全部由非金属元素组成的物质也可形成离子化合物,如NH4Cl。
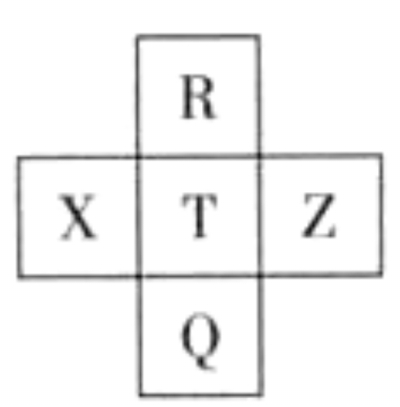
【典例6】(2013年广东理综)元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R <T<Q
D. 最高价氧化物的水化物的酸性:T>Q
解析:根据R单质在暗处与H2剧烈化合并发生爆炸的性质,可知R为氟元素,由此可知,X为硫元素、T为氯元素、Z为氩元素、Q为溴元素。X、T、Z为同一周期,从左向右非金属性依次增强(稀有气体除外),故A选项错误。R为9号元素,Q为35号元素,两者的核外电子数相差26,B选项正确。R、T、Q为同主族元素,从上到下其氢化物的稳定性减弱,C选项错误。非金属性越强,最高价氧化物的水化物的酸性越强,D选项正确。|
答案:BD
考点七 化学实验基础知识
复习策略:化学实验的选择题以化学实验操作和元素化合物性质知识为载体,考查分析解决化学实验问题的能力。在复习中,要注意对实验基本操作、物质制取方法、物质检验方法的知识进行分析和归纳,掌握正确的化学实验方法及原理,关注化学实验中的一些细节问题,提高实验方案的设计与评价能力。
重点知识与注意问题
①试管、坩埚和蒸发皿均可以直接加热,坩埚用于固体物质的灼烧,蒸发皿用于溶液的蒸发、浓缩和结晶。
②蒸馏时温度计水银球的位置位于蒸馏烧瓶的支管口附近,用乙醇制乙烯时温度计插入反应液中。
③滴定管的“0”刻度在上方;酸式滴定管(具有玻璃活塞)可盛放酸液和强氧化性溶液,不能盛放碱液;碱式滴定管可盛放碱液,不能盛放酸液和强氧化性溶液。
④测定溶液pH的操作:用玻璃棒蘸取少量待测液滴到pH试纸上(试纸不能用水湿润),再和标准比色卡对照,读出对应的pH。检验气体时,酸性气体用蓝色的石蕊试纸,碱性气体用红色的石蕊试纸,氧化性的气体用淀粉碘化钾试纸,且试纸均要用蒸馏水湿润。
⑤氢氧化铁胶体的制备:往煮沸的蒸馏水中逐滴滴加饱和的FeCl3溶液,当溶液变红褐色时,立即停止加热。
⑥浓硫酸稀释操作:将浓硫酸沿烧杯壁缓缓注入水(或乙醇、硝酸、乙酸)中,并不断搅拌。
⑦焰色反应的操作:先将铂丝蘸盐酸溶液在酒精灯火焰上灼烧,反复几次,直到与酒精灯火焰颜色接近为止,然后用铂丝蘸取少量待测液,到酒精灯火焰上灼烧,观察火焰颜色,如为黄色,则说明溶液中含Na+;若透过蓝色钴玻璃呈浅紫色,则说明溶液中含K+。
⑧铵根离子的检验要加碱、加热后用石蕊试纸检验氨气(使湿润的红色石蕊试纸变蓝);用碳酸氢钠除去二氧化碳气体中混有的二氧化硫、氯化氢;用饱和食盐水除去氯气中混有的氯化氢。
⑨加入稀盐酸后产生的气体能澄清石灰水变浑浊,溶液中不一定存在碳酸根离子(可能含碳酸氢根离子);加入氯化钡产生沉淀的溶液不一定含有硫酸根离子(可能含碳酸根离子或银离子)。