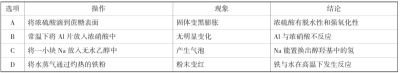
【典例7】(2013年广东理综)下列实验的现象与对应结论均正确的是
解析:浓硫酸滴到蔗糖表面时,固体变黑是由于硫酸的脱水性将蔗糖中的氢原子与氧原子按2:1脱去水分子生成碳单质,固体膨胀是由于碳单质被浓硫酸氧化生成CO2、SO2气体,A选项正确。常温下Al片放入浓硝酸中无明显变化,是由于铝遇到浓硝酸发生钝化,钝化过程有化学反应,B选项错误。无水乙醇能与钠反应置换出氢气,C选项正确。水蒸气与铁粉在加热时生成黑色的四氧化三铁,不是红色的氧化铁,D选项错误。
答案:AC
考点八 电解质电离与盐的水解问题
复习策略:这类试题重点考查弱电解质(弱酸、弱碱、水)的电离和盐的水解知识的综合运用,具有一定的难度。在复习中,一要注意理解弱电解质的电离、盐类水解的本质,学会利用平衡移动的规律分析具体的问题,二要理解和掌握电荷守恒、物料守恒的规律,学会运用这两个守恒灵活分析问题。
重点知识与注意问题
①要注意理解弱电解质电离、盐的水解的关系。如由于醋酸部分电离,盐酸完全电离,同浓度的醋酸和盐酸,盐酸的c(H+)较大,同c(H+)的醋酸和盐酸,醋酸的浓度较大,氯离子不水解,醋酸根离子水解等知识之间的联系。
②相同pH的盐酸和醋酸加水稀释同样的倍数,盐酸的pH变化大(即稀释后盐酸的pH大于醋酸)。相同pH的氢氧化钠和氨水加水稀释同样的倍数,氢氧化钠溶液的pH变化大(即稀释后氢氧化钠溶液的pH小于氨水)。
③酸和碱都抑制水的电离,常温下酸和碱溶液中水电离的氢离子或氢氧根离子的浓度一定小于1×10-7mol·L-1。能水解的盐促进水的电离。常温下能水解的盐碱溶液中水电离的氢离子或氢氧根离子的浓度一定大于1×10-7mol·L-1。例如:pH=3的醋酸和盐酸,水电离的c(H+)均为1×10-11 mol·L-1,pH=3氯化铵水电离的c(H+)为1×10-3mol·L-1。pH=11的氨水和氢氧化钠,水电离的c(H+)均为1×10-11 mol·L-1,pH=11醋酸钠水电离的c(H+)为1×10-3mol·L-1。
④等物质的量浓度的一元酸和一元碱溶液等体积混合后,强酸与强碱呈中性(常温下pH=7),弱酸与强碱呈碱性(常温下pH>7),强酸与弱碱呈酸性(常温下pH<7)。
⑤常温下,pH=3的某一元酸溶液与pH=11的一元碱溶液等体积混合后,强酸与强碱的混合液呈中性(pH=7),弱酸与强碱的混合液呈酸性(常温下pH<7),强酸与弱碱的混合液呈碱性(常温下pH>7)。
⑥温度不变时,电离常数Ka、水的离子积KW均不改变,升温时可促进弱电解质的电离和盐的水解,弱酸的酸性会增强,碳酸钠的碱性会增强,溶液KW会增大。
⑦电荷守恒:溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数。由于是同一溶液中,所以表现为浓度的相等关系。利用电荷守恒分析题目时常常会收到事半功倍的效果。如,一定浓度的Na2CO3溶液和NaHCO3中:c(Na+)+c(H+)=2c(CO23-)+c(OH-)+c(HCO-3);盐酸与氨水混合时,混合溶液中一定存在c(H+)+ c(NH4+)=c(Cl-)+c(OH-)。
⑧物料守恒:原子个数守恒或质量守恒。如,NaHCO3溶液中:c(Na+)=c(HCO-3)+c(CO23-)+c(H2CO3)。Na2CO3溶液中:c(Na+)=2[c(HCO-3)+c(CO23-)+c(H2CO3)]。
【典例8】(2013年广东理综)50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A. pH=4的醋酸中:c(H+)=4.0molL-1
B. 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C. 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+ c(OH-)
D. pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
解析:pH=-lg c(H+),pH=4的醋酸中c(H+)一定等于1.0×10-4molL-1,A选项错误。碳酸氢钠中电离出的碳酸氢根离子由于即水解又电离,c(HCO3-)一定小于c(Na+),B选项错误。根据溶液阴离子带的负电荷一定等于阳离子带的正电荷规律,C选项正确。在50℃时水的离子积大于1.0×10-14,pH=12的纯碱溶液c(H+)= 1.0×10-12molL-1,c(OH-)大于1.0×10-2molL-1,D选项错误。
答案:C
(作者单位:广州市第四十七中学)
责任编校 李平安